Grandezza della papilla
La grandezza
della papilla non è costante per tutti i soggetti, ma mostra una variabilità
inter-individuale di circa 1:7; il che significa che vi sono occhi normali
anche se hanno una papilla piuttosto piccola o, per converso, molto grande. I
soggetti di razza caucasica hanno una papilla relativamente piccola, seguiti
da messicani, asiatici e soggetti americani di razza nera. Nel glaucoma la
papilla ha dimensioni normali, fatta eccezione nel caso del glaucoma primario
ad angolo aperto nei soggetti con miopia elevata, nei quali è presente una
macro papilla secondaria (o acquisita). La predisposizione al glaucoma
probabilmente non è correlata con la grandezza della papilla. Essa può essere
determinata mediante planimetria di una sua fotografia; oppure con
oftalmoscopi confocali a scansione laser (SLO); oppure ancora con una normale
lampada a fessura nella quale la lunghezza del fascio luminoso può essere
regolata sul diametro della papilla.
Considerato come un equivalente
intrapapillare delle fibre nervose retiniche e delle fibre del nervo ottico,
il bordo neuroretinico è uno dei punti di repere principali nella valutazione
del nervo ottico. Nei soggetti normali la grandezza del bordo della
neuroretina non è costante inter-individualmente, ma evidenzia una variabilità
tra i soggetti molto marcata, similmente a quanto avviene per la papilla e
l'escavazione papillare. Essa è in relazione con l'area papillare: quanto più
grande è la papilla, tanto più grande è il bordo.
Bordo
neuroretinico
In soggetti normali, anche la grandezza del bordo
retinico varia da persona a persona ed è in relazione con la superficie
papillare; quanto più estesa è la papilla, tanto più grande è il bordo. In
occhi normali il bordo neuroretinico mostra una configurazione caratteristica,
risultando solitamente più ampio nella porzione inferiore della papilla, di
dimensioni progressivamente decrescenti nella porzione superiore, poi in
quella nasale e infine nella porzione temporale (regola dell'ISN'T) (gioco di
parole intraducibile, in quanto "ISN'T" in inglese significa "Non c'è",
sottintendendo che non c'è glaucoma quando è rispettato questo fisiologico
andamento del bordo, NdT).Questa morfologia peculiare del bordo è di
fondamentale importanza nella diagnosi di danno iniziale glaucomatoso del
nervo ottico.
Nel glaucoma si ha una riduzione della rima
neuroretinica in tutti i quadranti papillari, più marcatamente in alcuni
settori in funzione dello stadio della malattia. Questa perdita di neuroretina
non è patognomonica di una neuropatia ottica glaucomatosa, in quanto si
reperisce anche in occhi che abbiano sofferto di una neuropatia ottica
ischemica anteriore da arterite, e in taluni pazienti con tumori endocranici,
intra o sopra sellari. In occhi con danno glaucomatoso di modesta entità, la
riduzione del bordo si evidenzia soprattutto nelle porzioni infero e supero
temporali della papilla. In occhi con atrofia glaucomatosa un poco più
evoluta, la porzione papillare temporale orizzontale è quella che mostra una
riduzione relativamente più netta del bordo. In caso di glaucoma molto
avanzato, quello che resta del bordo è situato principalmente nella porzione
papillare nasale, con una porzione relativamente meno ridotta nella regione
nasale superiore che in quella nasale inferiore.
Questo ha come
conseguenza che per una diagnosi precoce di glaucoma si dovrebbero ricercare
alterazioni di tipo glaucomatoso soprattutto nelle porzioni papillari
temporali, inferiore e superiore.
Escavazione
papillare
Analogamente a quanto succede per la papilla e per il
bordo neuroretinico, anche l'escavazione papillare mostra un'alta variabilità
inter-individuale. In un occhio normale, le superfici papillari e
dell'escavazione sono correlate tra loro: quanto più grande è la papilla,
tanto più grande è l'escavazione. Nelle papille piccole, solitamente, non è
presente un'escavazione, mentre le papille grandi di solito hanno
un'escavazione molto ampia. Per porre una diagnosi di glaucoma su basi
morfologiche, questo dato caratteristico va tenuto presente. Se non si tiene
presente che papille piccole non hanno solitamente escavazione, un glaucoma
allo stadio iniziale o poco evoluto può erroneamente essere sottostimato in
pazienti con papille piccole e rapporto cup/disc (C/D) relativamente basso.
Gli occhi glaucomatosi con papilla piccola e quelli apparentemente
normali ma con escavazioni glaucomatose di piccole dimensioni, spesso mostrano
anormalità della regione peripapillare, quali una diminuzione di visibilità
dello strato delle fibre nervose retiniche, una riduzione del calibro delle
arteriole retiniche, a tipo diffuso o localizzato, ed un'atrofia corioretinica
peripapillare. Per contro, un'estesa escavazione in una papilla di grandi
dimensioni non dovrebbe portare alla diagnosi di glaucoma, se le altre
variabili da prendere in considerazione (principalmente l'aspetto del bordo
neuroretinico e la visibilità dello strato delle fibre nervose retiniche) sono
normali.
Poiché la papilla è ovalizzata in
senso verticale e l'escavazione in senso orizzontale, nei soggetti normali i
rapporti C/D sono più elevati per i diametri orizzontali che per quelli
verticali. Negli occhi normali, solo meno del 7% ha un rapporto C/D
orizzontale più piccolo del verticale. Poiché il rapporto C/D dipende dalla
grandezza della papilla e dell'escavazione, l'alta variabilità
inter-individuale di ambedue i parametri, rende ragione del perché in una
popolazione normale il rapporto C/D può andare da 0.0 fino a 0.9. In
conseguenza della correlazione tra superfici della papilla e dell'escavazione,
il rapporto è basso nelle papille di piccolo diametro e alto in quelle di
grande diametro. Un rapporto C/D insolitamente elevato, pertanto, può essere
fisiologico in occhi con papille grandi, mentre un rapporto C/D nella media è
raro in occhi normali ma con papille piccole.
 |
 |
|
Fig.
1 |
Fig.
2 |
Emorragia a scheggia
Un'altra caratteristica
dell'atrofia ottica glaucomatosa sono le emorragie a forma di scheggia o a
fiamma, localizzate sul bordo papillare. Difficili da riscontrare in occhi
normali, le emorragie papillari sono evidenziabili in circa il 4-7% degli
occhi glaucomatosi. La loro frequenza è massima nelle fasi precoci del
glaucoma. Nei glaucomi cronici semplici iniziali, esse si localizzano
solitamente nelle porzioni temporali inferiori o superiori della papilla. Si
riscontrano un poco meno spesso nel glaucoma secondario ad angolo aperto,
mentre sono un poco più frequenti nel tipo focale del glaucoma a pressione
normale.
Secondo le dimensioni iniziali, rimangono visibili, dopo la
comparsa, per un periodo variabile da 8 giorni a 12 settimane. Dopo un lasso
di tempo equivalente, spesso si evidenzia nello strato delle fibre nervose
retiniche un difetto localizzato, oppure l'ampliamento di un difetto
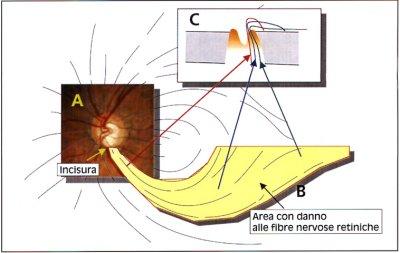
localizzato preesistente, oppure ancora un'incisura nel bordo neuroretinico a
cui corrisponde uno scotoma circoscritto del campo visivo. L'importanza
diagnostica delle emorragie papillari si fonda sulla loro elevata specificità,
in quanto in occhi normali si riscontrano solo raramente; pertanto esse di
solito segnalano la presenza di un danno glaucomatoso del nervo ottico, anche
se il campo visivo sembra apparentemente normale, oppure rivelano una
progressione della malattia glaucomatosa.
Atrofia
peripapillare
L'atrofia corioretinica peripapillare sul contorno
della papilla è stata divisa in una zona beta centrale ed una zona alfa
periferica. La zona periferica (alfa) è caratterizzata da un'ipo e
iperpigmentazione irregolare e da un assottigliamento interno dello strato del
tessuto corioretinico. Sul suo lato esterno è confinante con la retina, e sul
suo lato interno è in contatto rispettivamente o con la zona beta o con
l'anello sclerale peripapillare. Caratteristiche della zona più interna (beta)
sono una marcata atrofia dell'epitelio pigmentato retinico e della
coriocapillare, una buona visibilità dei grandi vasi coroideali e della
sclera, un assottigliamento dei tessuti corioretinici e confini circolari con
la zona alfa adiacente. Essa è delimitata perifericamente dall'adiacente zona
alfa e centralmente dall'anello sclerale peripapillare. Quando entrambe le
zone siano presenti, la zona beta è sempre più vicino alla papilla che la zona
alfa. Ad un esame psicofisico, la zona beta corrisponde ad uno scotoma
assoluto e la zona alfa ad uno scotoma relativo.
In occhi normali le
zone alfa e beta sono più grandi e frequenti nel settore temporale
orizzontale, seguito dall'area inferiore temporale e dalla regione superiore
temporale. Sono più piccole e rare nell'area peripapillare nasale. Una zona
alfa è presente in quasi tutti gli occhi normali ed è quindi più comune di una
zona beta (frequenza media in occhi normali: circa 15%-20%). Le zone alfa e
beta devono essere differenziate dal crescente sclerale in occhi con miopia
elevata alta e dal crescente sclerale inferiore in occhi con disversione
papillare. Taluni, ma non tutti gli occhi con glaucoma, mostrano un'atrofia
peripapillare anormalmente grande, specialmente nella zona beta.
Ciò
dipende dal tipo di glaucoma: l'atrofia peripapillare è più grande in occhi
con un glaucoma cronico semplice di tipo atrofico correlato all'età, e più
piccola in occhi con glaucoma cronico semplice di tipo giovanile e nel
glaucoma a pressione normale a tipo focale. L'ubicazione dell'atrofia
corioretinica peripapillare negli occhi con glaucoma è correlata spazialmente
con la perdita del bordo neuroretinico nella zona intrapapillare. Dimensione,
forma e frequenza di entrambe le zone non differiscono tra occhi normali ed
occhi con atrofia non glaucomatosa del nervo ottico in modo significativo. Una
valutazione dell'atrofia peripapillare, pertanto, serve anche per
differenziare una neuropatia ottica glaucomatosa da un danno non glaucomatoso
del nervo ottico.
Arteriole retiniche
Un
restringimento diffuso delle arteriole della retina è evidenziabile in occhi
con svariati tipi di danno del nervo ottico, indipendentemente dalla sua
patogenesi. Il restringimento del vaso aumenta con il progredire della
neuropatia ottica. Oltre ad un restringimento diffuso delle arteriole
retiniche, nella regione peripapillare di occhi con glaucoma o neuropatia
ottica non glaucomatosa può essere riscontrato un restringimento focale
arteriolare. Questo significa che un restringimento localizzato del vaso non è
specifico per un glaucoma, e che esso quindi non riveste un ruolo fondamentale
e specifico nella patogenesi della malattia.
Strato delle
fibre nervose retiniche
Lo strato delle fibre nervose retiniche
contiene l'assone delle cellule ganglionari della retina, coperto da astrociti
e arrangiato in fasci dai processi delle cellule di Muller. Poiché fa parte
delle vie ottiche afferenti, la sua valutazione è essenziale per la diagnosi
di anomalie e alterazioni patologiche del nervo ottico. Può essere valutato
oftalmoscopicamente o con fotografie grandangolari rosso-prive. Per la sua
valutazione oftalmoscopica è utile usare una luce verde. In occhi con mezzi
diottrici opachi, con una colorazione giallastra del cristallino oppure con
una scarsa pigmentazione dell'epitelio pigmentato retinico, lo strato delle
fibre nervose retiniche è meno visibile che in occhi con mezzi diottrici
limpidi e con un epitelio pigmentato retinico molto addensato. In aggiunta
all'accertamento della forma del bordo neuroretinico, la valutazione della
visibilità dello strato delle fibre nervose retiniche è della massima
importanza per una valutazione oftalmoscopica del nervo ottico.
In occhi
normali, la visualizzazione dello strato delle fibre nervose retiniche è
distribuita sul fondo oculare in modo disuguale. Dividendo il fundus in otto
settori, i fasci delle fibre nervose sono meglio visibili nel settore
temporale inferiore, seguito dal temporale superiore, dal nasale superiore e
infine dal settore nasale inferiore. Sono invece meno visibili nei settori
superiore, inferiore, temporale orizzontale e nasale orizzontale.
Di
pari passo, il diametro delle arterie retiniche è significativamente maggiore
in corrispondenza del margine papillare temporale inferiore, seguito dall'area
temporale superiore, dall'area nasale superiore e da ultimo dall'area nasale
inferiore.
Ciò è in accordo con l'ubicazione della foveola sotto una linea
orizzontale passante per il centro della papilla, e con la configurazione del
bordo neuroretinico che è più largo al margine papillare temporale inferiore,
seguito dalla regione temporale superiore.
La visibilità dello strato
delle fibre nervose retiniche diminuisce con l'età, in relazione con una
perdita di fibre del nervo ottico correlata all'invecchiamento, ad un tasso
annuale di riduzione di circa 4.000-5.000 fibre (rispetto ad una popolazione
iniziale alla nascita di circa 1,4 milioni di fibre del nervo ottico).
In
occhi glaucomatosi, la visibilità dello strato delle fibre nervose retiniche è
ridotta in funzione della perdita di fibre del nervo ottico. Le alterazioni
glaucomatose nello strato delle fibre nervose retiniche possono essere divise
in difetti localizzati o in una perdita diffusa.
I difetti localizzati
sono definiti come cuneiformi e si dirigono verso la papilla o arrivano in
contatto con il suo margine. Se sono molto marcati, possono avere una base
larga sul rafe temporale del fundus, e sono presenti tipicamente in circa il
20% o più di tutti gli occhi con glaucoma. Possono però essere trovati anche
in occhi con un'atrofia del nervo ottico dovuta ad altre cause, ad esempio
drusen della papilla, cicatrici corioretiniche da toxoplasmosi, retinopatie
ischemiche con essudati retinici cotonosi, dopo un papilledema protratto nel
tempo o dopo neuriti ottiche dovute a sclerosi multipla. Dato che difetti
localizzati dello strato delle fibre nervose retiniche non sono presenti in
occhi normali, quasi sempre essi significano un'alterazione patologica. Va
tenuto in considerazione, nondimeno, che non sono patognomonici per un
glaucoma, in quanto sono presenti anche in altri tipi di atrofia del nervo
ottico.
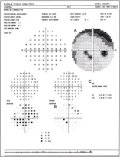
Oltre ai difetti localizzati, può verificarsi una perdita
diffusa di fibre nervose retiniche in occhi con un danno del nervo ottico
glaucomatoso o non glaucomatoso. Per evidenziare variazioni, è utile servirsi
della cosiddetta "sequenza dei settori del fundus riguardo alla migliore
visibilità dello strato delle fibre nervose retiniche". Se si scopre che in un
occhio, senza irregolarità del fundus, lo strato delle fibre nervose retiniche
è nettamente più visibile nel settore temporale superiore che in quello
temporale inferiore, ci si indirizza verso una perdita prevalentemente nella
regione del fundus temporale inferiore. E' anche utile valutare se i vasi
retinici sono chiaramente e nettamente definibili: normalmente essi sono
collocati nello strato delle fibre nervose retiniche. In occhi con una perdita
diffusa dello strato delle fibre nervose retiniche, i vasi sono ricoperti solo
dalla membrana limitante interna; questo determina come conseguenza una
visibilità migliore ed un'immagine più nitida dei grandi vasi
retinici.
Tenendo conto della
facilità con cui si può procedere ad una valutazione oftalmoscopica e della
sua grande importanza nell'accertamento di anomalie e malattie del nervo
ottico, durante ogni oftalmoscopia di routine lo strato delle fibre nervose
retiniche dovrebbe essere accuratamente esaminato. Ciò risulta vero
specialmente per pazienti con un danno precoce del nervo ottico. Questo dato è
della massima importanza per la scoperta di un glaucoma in occhi con una
papilla piccola ed una piccola escavazione, apparentemente normale ma in
realtà glaucomatosa; ed è utile per classificare come normale un occhio con
una papilla grande e un'escavazione marcata, apparentemente glaucomatosa ma in
realtà normale. In occhi con un'atrofia del nervo ottico già avanzata, altre
tecniche d'esame, come la perimetria, possono essere più utili per il
follow-up del danno al nervo ottico.
Riassumendo le
linee guida per l'accertamento della morfologia della testa del nervo ottico,
le variabili più utili per indicare un danno glaucomatoso del nervo ottico
sono una forma anormale del bordo neuroretinico papillare ed una ridotta
visibilità dello strato delle fibre del nervo. Le variabili più specifiche
sono la presenza di un difetto circoscritto dello strato delle fibre nervose
retiniche e la comparsa di emorragie papillari a forma di scheggia.
Queste anormalità morfologiche spesso precedono le alterazioni
psicofisiche o elettrofisiologiche, particolarmente la perimetria
convenzionale con stimolo bianco-su-bianco. Poiché esse possono essere
valutate con facilità semplicemente utilizzando un oftalmoscopio, la
valutazione morfologica della testa del nervo ottico è la tecnica diagnostica
di scelta per scoprire fin dalle prime fasi un danno glaucomatoso del nervo
ottico in soggetti con ipertono oculare ed in malati con glaucoma a pressione
normale in "fase pre-perimetrica". Studi ulteriori potranno mostrare, in
futuro, se tecniche più recenti come la perimetria a stimolo blu-giallo e la
perimetria con stimolazione flicker possono evidenziare più precocemente,
rispetto all'esame morfologico della papilla, un danno del nervo ottico.

Esame dello strato delle fibre
nervose retiniche


Il glaucoma è una malattia ad eziologia multifattoriale che
provoca un danno degli assoni delle cellule ganglionari nel fondo dell'occhio.
La perdita delle fibre nervose conferisce un aspetto glaucomatoso tipico alla
papilla ottica. Oltre alla papilla ottica, si può osservare un'atrofia degli
assoni delle cellule ganglionari anche nello strato di fibre nervose retiniche
(RNFL). In effetti, un difetto del RNFL può essere il segno più precoce di
glaucoma che precede le alterazioni della configurazione della papilla ottica
e del campo visivo. Quindi un aspetto normale della papilla e un campo visivo
normale non devono necessariamente far escludere un glaucoma.
Anormalità
dello strato di fibre nervose retiniche in pazienti affetti da glaucoma sono
state riferite per la prima volta da Hoyt et al. nel 1973. Le prime
alterazioni osservabili riscontrate da questo autore erano difetti sottili,
simili ad una fessura, o solchi nell'area arcuata del RNFL. In casi più
avanzati si sono sviluppati difetti localizzati cuneiformi.
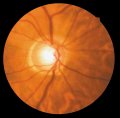
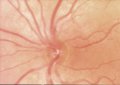
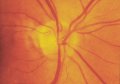
Il RNFL sano
appare sotto forma di striature orientate regolarmente (Fig. 1), che sono
formate da fasci di assoni, compartimentalizzati a tunnel, formati dai
processi delle cellule di Müller. Queste striature si osservano perché la luce
è riflessa dai fasci nervosi e dai setti gliali di separazione. Esse vengono
riconosciute più facilmente nella regione peripapillare e nell'area delle
fibre arcuate al di sopra e al di sotto della macula. In queste aree vi sono
numerosi fasci di fibre nervose per ogni striscia e lo strato delle fibre
nervose è più denso. Le fibre nervose sono più difficili da visualizzare nel
sottile rafe temporale e nell'area nasale in cui le striature sono costituite
da un fascio di fibre per ogni striscia. Il RNFL è di maggior spessore
nell'area peripapillare, in particolare nel segmento temporale superiore o
inferiore, dove può raggiungere lo spessore di 300 µm (Quigley e Addicks,
1982). Le fibre nervose originano dalle cellule della retina periferica,
curvano attorno alla macula e convergono nel canale coriosclerale che
costituisce la maggior parte del tessuto della papilla
ottica.
L'organizzazione retinica delle fibre nervose è probabilmente tale
che le fibre che originano in sede più periferica sono situate in profondità
nella retina, più vicino all'epitelio pigmentato. Le fibre che originano più
prossimalmente si trovano più superficialmente nella retina, più vicino al
corpo vitreo. Nella papilla ottica i fasci di fibre nervose superficiali sono
situati centralmente, mentre le fibre che hanno origine più perifericamente
sono situate più vicino al margine del canale coriosclerale. Infatti questa
organizzazione dei fasci di fibre determina la sede e la forma del campo
visivo glaucomatoso.
In un esame clinico di routine è possibile osservare
il RNFL con luce verde alla lampada a fessura con una lente di Volk o una
lente a contatto di Goldmann. I fasci di fibre nervose possono essere seguiti
fino al livello della macula. È utile regolare la fessura più grande e piatta,
quasi quadrata, per poter vedere aree più grandi in una sola volta. L'aspetto
opaco, leggermente argenteo, dei fasci di fibre nervose, è facilmente
riconoscibile. Con un oftalmoscopio si può seguire l'andamento a striscia per
circa un diametro di distanza dalla papilla ottica. E' utile dapprima valutare
il nervo ottico e poi vedere se l'aspetto del RNFL confermi i reperti della
papilla ottica. D'altra parte può darsi che un difetto cuneiforme localizzato
nel RNFL richiami l'attenzione verso una sede specifica sulla papilla,
aiutando così a riconoscerne le alterazioni iniziali.
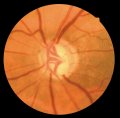
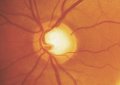
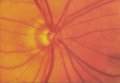
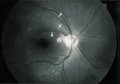
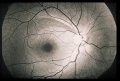
Il glaucoma può
provocare un danno localizzato (Fig. 2) o diffuso (Fig. 3) del RNFL o un
insieme di entrambi. I problemi nella valutazione dello strato di fibre
nervose spesso riguardano una sovrastima dei difetti locali e una sottostima
della perdita di fibre nervosa diffusa. Nel 50% degli occhi che sviluppano un
glaucoma, la prima anormalità riconoscibile del RNFL è rappresentata da una
perdita diffusa di assoni, in altre parole, un assottigliamento generalizzato
del RNFL. Nelle fasi iniziali ciò non è sempre facile da riconoscere, fino a
quando non è associato ad un ingrandimento generalizzato dell'escavazione
papillare (Tuulonen e Airaksinen, 1990). I difetti cuneiformi localizzati del
RNFL (Fig. 2) sono riconosciuti assai più facilmente. La punta più
ristretta del cuneo si trova più spesso al margine papillare o nell'area
peripapillare in sede temporale superiore o inferiore.
Nel corso degli anni
è apparso evidente che, in molti casi, le anormalità del RNFL sono i primi
segni riconoscibili del glaucoma iniziale. Quindi abbiamo eseguito un progetto
di screening della popolazione con una macchina fotografica per il fondo, con
obiettivo grandangolare, all'infrarosso. Con questa macchina fotografica si
può osservare su uno schermo televisivo il fondo degli occhi del paziente con
illuminazione infrarossa ed effettuare una fotografia con un flash normale.
Questa tecnica è abbastanza rapida e sicura, poiché non è necessario dilatare
la pupilla.
In una popolazione di parenti di I grado sani di pazienti
affetti notoriamente da glaucoma, la qualità dell'immagine era buona od ottima
nel 90% dei casi e scarsa o scadente, ma valutabile, nel 5% dei casi. I
pazienti con reperti della papilla ottica e del RNFL anormali o sospetti sono
stati inviati a consulto nella Clinica Oculistica dell'Università per un esame
oculare completo. In 6 dei 31 casi inviati a consulto con anormalità del RNFL
si sono riscontrati i classici segni di glaucoma, con piccole anormalità del
campo visivo. Nove pazienti hanno presentato solo tipiche anormalità del RNFL
con aspetto normale della papilla e campo visivo normale. Sembra che lo
screening della popolazione con questa tecnica permetta un risparmio di tempo
e di costo.
Anche se l'analisi del RNFL richiede un certo tempo per essere
appresa, essa fornirà molte informazioni supplementari al medico da associare
alla valutazione della papilla e campo visivo. Tuttavia uno degli
inconvenienti è che la valutazione del RNFL è soggettiva e qualitativa, ma
ciò, ovviamente, vale anche per la valutazione della sola papilla. Di recente
sono state messe a punto tecniche promettenti, mediante una tecnologia di alto
livello, per quantificare le anormalità del RNFL misurando lo spessore o il
contorno del RNFL. Tale apparecchiatura, che utilizza un raggio laser a
scansione coerente, ha il vantaggio di essere relativamente insensibile a
pupille piccole e alla presenza di una cataratta. Quando sarà a disposizione
del medico, questa tecnica potrà migliorare notevolmente la diagnosi e il
controllo a distanza del glaucoma.



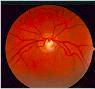
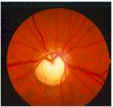
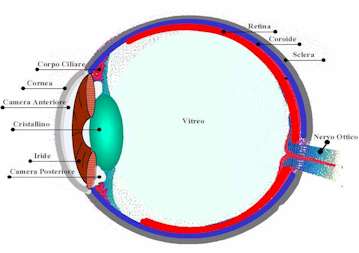
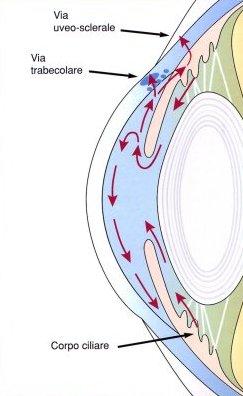

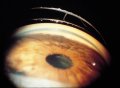

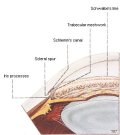
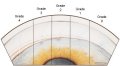
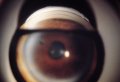

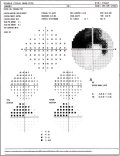
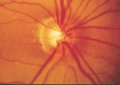
 Fig.
7
Fig.
7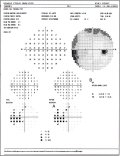












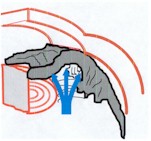 In tali occhi l'angolo della camera anteriore
per effetto di vari stimoli può chiudersi impedendo la fuoriuscita dell'umore
acqueo. Ne consegue un aumento della pressione oculare più o meno
violento.
In tali occhi l'angolo della camera anteriore
per effetto di vari stimoli può chiudersi impedendo la fuoriuscita dell'umore
acqueo. Ne consegue un aumento della pressione oculare più o meno
violento.