

Tra le nuove terapie attualmente in via di definizione un ruolo importante
spetta all’iniezione endoculare di una sostanza: il triamcinolone.
Negli ultimi cinque anni circa abbiamo assistito al ritorno alla ribalta di un
farmaco cortisonico, il Triamcinolone Acetonide (TA) che era già in uso nel
passato nel mondo oftalmologico per iniezione periorbitaria. Gli impieghi finora
riportati in letteratura sono vari, e certo, come spesso accade per le nuove
opportunità diagnostiche e terapeutiche, se da un lato è giusto considerarle,
dall'altro è indispensabile avere un approccio serio e motivato, prudente e
responsabile.
Il Triamcinolone Acetonide ha dimostrato potenti capacità antiangiogenetiche nei
confronti della neovascolarizzazione sottoretinica: inibisce la
vitreoretinopatia proliferante nel coniglio e la neovascolarizzazione retinica
dopo insulto ischemico nel maiale, la proliferazione fibroblastica nell'occhio
umano. Il meccanismo d'azione implica un'azione diretta sulle cellule
endoteliali ed un'azione indiretta di inibizione della migrazione ed attivazione
dei macrofagi, dei mastociti ed di altre cellule infiammatorie che rilasciano
fattori di crescita angiogenici. Quanto all'effetto sull'edema maculare, in
realtà al di là delle prove cliniche, il meccanismo d'azione è al momento solo
ipotizzato. Conosciamo l'effetto antinfiammatorio degli steroidi perché
interferiscono con la cascata dell'acido arachidonico, i cui prodotti (prostaglandine)
sono responsabili della rottura della barriera ematoretinica interna. Questa
azione può spiegare l'efficacia del farmaco nell'EMC postchirurgico e
postuveitico.
La terapia intravitreale con Triamcinolone Acetonide (IVTA): studi di
letteratura
IVTA ed edema maculare
Le cause più frequenti di edema maculare (EM) sono la retinopatia diabetica,
l'occlusione venosa retinica e le uveiti croniche (tabella 1).
L'applicazione del triamcinolone intravitreale più indagata finora è quella
dell'edema maculare cistoide o diffuso secondario a retinopatia diabetica.
Massin e collaboratori (1) hanno pubblicato i risultati preliminari di uno
studio prospettico controllato su 12 pz seguiti per almeno 3 mesi e comunque non
oltre i sei mesi, valutando l'efficacia di 4 mg di farmaco sulla base
dell'acuità visiva e dello spessore maculare misurato con OCT. I pazienti
arruolati erano stati sottoposti già a trattamento laser dell'EM senza
efficacia. Gli autori hanno dimostrato una significativa riduzione dello
spessore maculare a 4 e 12 settimane dal trattamento, con una recidiva
dell'edema al controllo a 24 settimane in 5 su 12 soggetti. Quanto all'acuità
visiva, non è stata dimostrata una efficacia del trattamento almeno a breve
termine.
Analoghi risultati erano già stati ottenuti da Martidis e coll. (2) in uno
studio non controllato con il 55% e 58% di riduzione dello spessore maculare a 1
e 3 mesi dal trattamento con 4 mg.
Jonas e coll. (3), seppur con dosi maggiori (25 mg), hanno ottenuto un
miglioramento dell'acuità visiva nell'81% dei casi a partire da 1 mese fino a
sei mesi dopo l'iniezione, con riduzione statisticamente significativa del
leakage fluoresceinico.
Park e coll. (4) hanno trattato 10 casi di edema maculare secondario
all'occlusione della vena centrale della retina, ottenendo una riduzione dello
spessore maculare all’OCT e un miglioramento dell’acuità visiva statisticamente
significativo nell’ambito di un follow-up medio di circa 5 mesi.
L'edema maculare cistoide postuveitico è stato trattato con IVTA in una piccola
serie di casi, 12 in totale negli unici due lavori significativi (5,6), con 4 mg
in entrambi i lavori e con una risposta terapeutica dimostrata tra le 4 e le 12
settimane dal trattamento sia in termini di acuità visiva che con riduzione
dello spessore maculare all'OCT. Entrambi i lavori però riportano un tasso di
recidiva quasi del 100% dopo 12 settimane dal trattamento e in 6/12 pazienti si
è osservato un ipertono secondario che in un caso è stato controllato con la
trabeculectomia. Il triamcinolone acetonide è stato inoltre valutato in corso di
vitrectomia via pars plana (VPP) come coadiuvante nella visualizzazione e
rimozione della ialoide posteriore e antinfiammatorio locale (7,8).
IVTA e neovascolarizzazione sottoretinica (NVSR)
Il Triamcinolone Acetonide ha dimostrato nei topi la capacità di inibire la
neovascolarizzazione sottoretinica laser indotta (9, 10). Ha inoltre capacità
antiedemigene, come abbiamo più volte già indicato. Gli entusiasmi dei primi
lavori (11, 12) sono stati raffreddati dal lavoro di Gillies e coll. (13) che è
anche quello con il più lungo follow-up finora pubblicato. Una singola iniezione
di 4 mg in 0,1 ml in 73 occhi affetti da NVSR classica non ha dimostrato
efficacia sul rischio di perdita visiva in uno studio a doppio cieco,
randomizzato contro placebo, con un follow-up di 1 anno; per contro è stata
osservata una riduzione od una stabilizzazione della NVSR a tre mesi
significativamente più importante che nel gruppo controllo. Più recentemente
Jonas e coll. (14) hanno valutato l’efficacia sull’acuità visiva di due
consecutive IVTA in 13 pazienti con NVSR occulta o prevalentemente occulta con
un follow-up medio dopo la seconda iniezione di circa 5 mesi. Gli autori hanno
riportato un miglioramento statisticamente significativo dell’acuità visiva
rispetto al gruppo di controllo (tabella 2).
Spaide e coll. (15) hanno riferito di 26 pazienti affetti da NVSR subfoveale di
qualunque tipo, trattati con terapia combinata PDT e successiva IVTA. Del gruppo
13 pazienti non erano mai stati trattati e 13 erano già stati sottoposti ad un
trattamento PDT. I risultati presentati suggeriscono un'azione sinergica delle
due terapie con un miglioramento dell'acuità visiva e un minor numero di
ritrattamenti nei due gruppi rispetto alla letteratura. Seppure con pochi
pazienti e senza un'omogeneità nella selezione dei casi, lo studio propone la
possibilità di coadiuvare l'efficacia della terapia fotodinamica con la
contemporanea riduzione dell'essudazione e con l'effetto antiangiogenetico del
triamcinolone.
Miscellanea
I cristalli di TA si depositano sulla ialoide posteriore consentendone la
visualizzazione in corso di vitrectomia ai fini di una completa rimozione (16),
analogamente a quanto accade per il verde di indocianina per la membrana
limitante interna (17), con un potenziale effetto antinfiammatorio locale utile
dopo l’intervento. Inoltre è stato suggerito in suo impiego per via
intravitreale prima dell’intervento per cataratta in occhi a rischio o già
colpiti da rubeosis iridis per retinopatia proliferante, per prevenire o
contrastare il glaucoma neovascolare secondario
In questi due OCT, prima e dopo iniezione del farmaco si nota il riassorbimento
del liquido
Complicanze
Essendo una pratica invasiva, non vanno trascurati gli effetti indesiderati
associati e le possibili complicanze.
- endoftalmite settica 0,9% (1) o asettica (19-21)
- ipertensione oculare 25% (12); 52% (22)
- emorragia sottocongiuntivale e/o endovitreale
- insorgenza/progressione di cataratta (fino al 60%) (11-12)
- distacco di retina,in percentuale ancora non definita ma che possiamo stimare
del 1-5%
- dolore, arrossamento oculare, sensazione di corpo estraneo
- transitoria comparsa di corpi mobili (cristalli di farmaco liberi in camera
vitrea)
Protocollo di trattamento
La terapia consta di una iniezione endoculare del farmaco che viene effettuata
in ambiente sterile, preferibilmente una sala operatoria, per minimizzare la
possibile insorgenza di complicanze.
La terapia viene effettuata in pochi minuti in anestesia locale con colliri, e
non è dolorosa. Subito dopo al paziente viene chiesto di tenere il capo in
posizione eretta per almeno due ore dopo il trattamento onde evitare la
distribuzione dei cristalli di TA al davanti del polo posteriore con disturbo
della visione centrale.
I controlli devono essere eseguiti dopo 1,7,15,30 giorni e poi secondo
valutazione personale.
Conclusioni
La terapia con Triamcinolone Acetonide per via intravitreale va mostrando un
grande potenziale di efficacia in condizioni, quali l’edema maculare cistoide,
per le quali le armi terapeutiche in nostro possesso non sono pienamente
efficaci. Questo iniziale entusiasmo però va controllato facendo attenzione a
due aspetti:
vanno definite con chiarezza le reali indicazioni a questa terapia, sulla base
di studi di efficacia con casistica numericamente qualificata;
vanno chiariti gli aspetti medico-legali relativi alla somministrazione di un
farmaco per via non indicata nell’autorizzazione ministeriale.
Bibliografia
Massin P, Andren F, Haouchine B, Erginay A, Bergmann JF, Benosman R, Caulin C,
Gaudric A. Intravitreal triamcinolone acetonide for diffuse macular edema.
Ophthalmology 2004; 111: 218-25.
Martidis A, Duker JS, Greenberg PB, Rogers AH, Puliafito CA, Reichel E, Baumal
C. Intravitreal triamcinolone for refractory diabetic macular edema.
Ophthalmology. 2002 May;109(5):920-7.
Jonas JB, Kreissig I, Sofker A, Degenring RF. Intravitreal injection of
triamcinolone for diffuse diabetic macular edema. Arch Ophthalmol. 2003 Jan;121(1):57-61.
Park CH, Jaffe GJ, Fekrat S. Intravitreal triamcinolone acetonide in eyes with
cystoid macular edema associated with central retinal vein occlusion. Am J
Ophthalmol. 2003 Sep;136(3):419-25.
Antcliff RJ, Spalton DJ, Stanford MR, Graham EM, Ffytche TJ, Marshall J.
Intravitreal triamcinolone for uveitic cystoid macular edema: an optical
coherence tomography study. Ophthalmology. 2001 Apr;108(4):765-72.
Young S, Larkin G, Branley M, Lightman S. Safety and efficacy of intravitreal
triamcinolone for cystoid macular oedema in uveitis. Clin Experiment Ophthalmol.
2001 Feb;29(1):2-6.
Benitez Del Castillo Sanchez JM, Garcia Sanchez J. [Intravitreal injection of
triamcinolone acetonide in non infectious uveitis] Arch Soc Esp Oftalmol. 2001
Nov;76(11):661-4.
Sonoda KH, Enaida H, Ueno A, Nakamura T, Kawano YI, Kubota T, Sakamoto T,
Ishibashi T. Pars plana vitrectomy assisted by triamcinolone acetonide for
refractory uveitis: a case series study. Br J Ophthalmol. 2003 Aug;87(8):1010-4.
Ciulla TA, Criswell MH, Danis RP, Hill TE. Intravitreal triamcinolone acetonide
inhibits choroidal neovascularization in a laser-treated rat model. Arch
Ophthalmol. 2001 Mar;119(3):399-404.
Ciulla TA, Criswell MH, Danis RP, Fronheiser M, Yuan P, Cox TA, Csaky KG,
Robinson MR. Choroidal neovascular membrane inhibition in a laser treated rat
model with intraocular sustained release triamcinolone acetonide microimplants.
Br J Ophthalmol. 2003 Aug;87(8):1032-7.
Challa JK, Gillies MC, Penfold PL, Gyory JF, Hunyor AB, Billson FA. Exudative
macular degeneration and intravitreal triamcinolone: 18 month follow up. Aust N
Z J Ophthalmol. 1998 Nov;26(4):277-81.
Danis RP, Ciulla TA, Pratt LM, Anliker W. Intravitreal triamcinolone acetonide
in exudative age-related macular degeneration. Retina. 2000;20(3):244-50.
Gillies MC, Simpson JM, Luo W, Penfold P, Hunyor AB, Chua W, Mitchell P, Billson
F. A randomized clinical trial of a single dose of intravitreal triamcinolone
acetonide for neovascular age-related macular degeneration: one-year results.
Arch Ophthalmol. 2003 May;121(5):667-73.
Jonas JB, Akkoyun I, Budde WM, Kreissig I, Degenring RF. Intravitreal
reinjection of triamcinolone for exudative age-related macular degeneration.
Arch Ophthalmol. 2004 Feb;122(2):218-22.
Spaide RF, Sorenson J, Maranan L. Combined photodynamic therapy with verteporfin
and intravitreal triamcinolone acetonide for choroidal neovascularization.
Ophthalmology. 2003 Aug;110(8):1517-25.
Peyman GA, Cheema R, Conway MD, Fang T. Triamcinolone acetonide as an aid to
visualization of the vitreous and the posterior hyaloid during pars plana
vitrectomy. Retina. 2000;20(5):554-5.
Kimura H, Kuroda S, Nagata M. Triamcinolone acetonide-assisted peeling of the
internal limiting membrane. Am J Ophthalmol. 2004 Jan;137(1):172-3.
Moshfeghi DM, Kaiser PK, Scott IU, Sears JE, Benz M, Sinesterra JP, Kaiser RS,
Bakri SJ, Maturi RK, Belmont J, Beer PM, Murray TG, Quiroz-Mercado H, Mieler WF.
Acute endophthalmitis following intravitreal triamcinolone acetonide injection.
Am J Ophthalmol. 2003 Nov;136(5):791-6.
Nelson ML, Tennant MT, Sivalingam A, Regillo CD, Belmont JB, Martidis A.
Infectious and presumed noninfectious endophthalmitis after intravitreal
triamcinolone acetonide injection. Retina. 2003 Oct;23(5):686-91.
Roth DB, Chieh J, Spirn MJ, Green SN, Yarian DL, Chaudhry NA. Noninfectious
endophthalmitis associated with intravitreal triamcinolone injection. Arch
Ophthalmol. 2003 Sep;121(9):1279-82.
Sutter FK, Gillies MC. Pseudo-endophthalmitis after intravitreal injection of
triamcinolone. Br J Ophthalmol. 2003 Aug;87(8):972-4.
Jonas JB, Kreissig I, Degenring R. Intraocular pressure after intravitreal
injection of triamcinolone acetonide. Br J Ophthalmol. 2003 Jan;87(1):24-7.
Beer PM, Bakri SJ, Singh RJ, Liu W, Peters GB 3rd, Miller M. Intraocular
concentration and pharmacokinetics of triamcinolone acetonide after a single
intravitreal injection. Ophthalmology. 2003 Apr;110(4):681-6.
Scholes GN, O'Brien WJ, Abrams GW, Kubicek MF. Clearance of Triamcinolone from
vitreous. Arch Ophthalmol 1985 Oct; 103(10): 1567-9.
Schindler RH, Chandler D, Thresher R, Machemer R. The clearance of intravitreal
triamcinolone acetonide. Am J Ophthalmol 1982;93:415-7.
Jonas JB, Kreissig I, Degenring RF. Endophthalmitis after intravitreal injection
of triamcinolone acetonide. Arch Ophthalmol. 2003 Nov;121(11):1663-4.
Nishimura A, Kobayashi A, Segawa Y, Sakurai M, Shirao E, Shirao Y, Sugiyama K.
Isolating triamcinolene acetonide particles for intravitreal use with a porous
membrane filter. Retina 2003; 23: 777-779.
La Terapia con il MACUGEN® della DEGENERAZIONE MACULARE.
La degenerazione maculare legata all’età (DMLE) è una patologia
cronico-degenerativa che aumenta con l’età ed è la prima causa di cecità legale
negli ultra 55-enni nei pazienti industrializzati.1
Nella sua patogenesi sembrano implicati diversi fattori: genetici, infiammatori,
ambientali, ma tuttora essa rimane non perfettamente chiara. L’inibizione dell’angiogenesi
dei neovasi in corso di DMLE è la nuova frontiera sulla quale si sta
sperimentando e studiando
Le terapie adesso in uso e di provata efficacia sono la fotocoagulazione laser
per i casi di CNV extrafoveale e iuxtafoveale e la terapia fotodinamica con
Verteporfina per le CNV subfoveali classiche o prevalentemente classiche.
La terapia fotodinamica (PDT) con uso di verteporfina (nome commerciale e
venditore) è più selettiva rispetto al laser. La PDT deve essere ripetuta più
volte perché sono frequenti le recidive con ricanalizzazione, leakage o crescita
di nuovi vasi.3 Questo effetto può essere causato dalla stimolazione della
produzione non bilanciata del fattore di crescita endoteliale (VEGF) e del
fattore derivante dall’epitelio pigmentato (PEDF) nelle cellule endoteliali
coroideali dell'area trattata.3-6
In alcuni casi la terapia causa un danno dell'epitelio pigmentato retinico (EPR)
esitando in un’area d’atrofia.3,7,8
Pertanto le ricerche continuano e altre terapie sono in fase di sperimentazione,
con l’obbiettivo prevalente di inibire i processi di angiogenesi.
L'angiogenesi: La neovascolarizzazione coroideale nella DMLE essudativa è
caratterizzata dall’espressione di VEGF, di angiopoietina, di fattore di
crescita derivato dalle piastrine (PDGF), di fattore di crescita tumorale beta (TGF-ß)
e da eventi come la coagulazione, l’infiammazione, l’angiogenesi e la fibrosi.
Normalmente la secrezione basale del VEGF e l’equilibrio tra fattori
pro-angiogenici e antiangiogenici da parte dell’EPR mantengono il trofismo della
coriocapillare, mentre nella DMLE, l’alterazione della membrana di Bruch fa
venir meno questa funzione, con conseguente atrofia della coriocapillare,
ipossia del neuroepitelio e stimolazione della produzione di VEGF.9
VEGF: Nell'uomo esistono almeno 4 isoforme di VEGF secondo il numero di
aminoacidi contenuti, ma la più importante è il VEGF165.
Il VEGF presenta una serie di effetti proangiogenici come la vasodilatazione e
l'aumento della permeabilità vascolare, il rilascio di enzimi proteolitici di
invasione e rimodellamento tessutale e la prevenzione dell'apoptosi endoteliale.
E' stato dimostrato che i valori oculari del VEGF aumentano e in maniera
proporzionale al grado di crescita e di leakage dei neovasi10,11, e
verosimilmente aumentano anche i suoi recettori della famiglia delle tirosin
chinasi: Flt-1, sulle cellule endoteliali vascolari, e Flk-1 che oltre che dalle
cellule endoteliali sono espresse anche dalle cellule tumorali e dai monociti.12,13
L’interazione con questi recettori porta all’aumentata permeabilità vascolare,
alla proliferazione delle cellule endoteliali e al richiamo di monociti.
Il pegaptanib sodico: Da tempo, e non solo per la DMLE, si stanno cercando
farmaci in grado di inibire il processo di angiogenesi per ciascuno dei passaggi
della sua cascata, utili non solo per la DMLE e la retinopatia diabetica, ma
anche come terapia contro i tumori. L'ultima novità arriva dagli USA ed è un
farmaco antiangiogenico: il pegaptanib sodico (MACUGEN®).
Il pegaptanib è un aptamero, vale a dire un piccolo frammento di RNA sintetico,
con conformazione tridimensionale e altamente specifica, che legandosi al
VEGF165 le impedisce il legame con il proprio recettore e la conseguente
formazione di vasi anomali e l’aumento della permeabilità vascolare. Pertanto
questo farmaco potrebbe essere usato in tutte quelle malattie caratterizzate da
crescita anomala di vasi ed aumentata permeabilità vascolare come la DMLE, la
retinopatia diabetica, le occlusioni venose retiniche, la retinopatia del
prematuro, i tumori, ecc. Gli aptameri hanno il vantaggio di non stimolare di
solito la risposta immunologica e così sembra essere anche con il MACUGEN®.
Per impedire la degradazione del farmaco da parte delle endonucleasi e delle
esonucleasi ed aumentare l'emivita del farmaco la molecola di pegaptanib è stata
legata ad un gruppo di polietilene glicole (PEG).
MACUGEN® (iniezione di pegaptanib sodico): Il MACUGEN® è fornito come soluzione
acquosa senza conservanti contenente pegaptanib sodico alla concentrazione di
0.3 mg/100µL, in siringa sterile monouso di 1 ml del tipo USP I con ago da 27
gauge, iniettando 0.1mL.
Oltre al farmaco la soluzione acquosa contiene anche cloruro di sodio, fosfato
di sodio monobasico monoidrato, fosfato di sodio bibasico eptaidrato, acido
cloridrico, e/o idrossido di sodio per raggiungere un pH di 6-7.
Emivita nel corpo vitreo e nel plasma: Negli animali da esperimento sottoposti
ad iniezione intravitreale di pegaptanib, esso è assorbito lentamente nella
circolazione sistemica. Dalla velocità di questo passaggio dipende l’emivita del
farmaco nel corpo vitreo, che negli animali è di circa 94 ore, mentre nell'uomo
è di 347 ore. I risultati sul tempo di permanenza del farmaco nel vitreo
giustificano una frequenza di somministrazione nell'uomo di una volta ogni 6
settimane.
Il farmaco è metabolizzato dalle eso- ed endonucleasi endogene e poi eliminato
dal rene, come è risultato dagli studi preclinici sul suo metabolismo ed
escrezione.
Studi clinici: Sono stati condotti due trias multicentrici, controllati,
randomizzati, a doppio cieco, che trattavano con Macugen pazienti con DMLE
neovascolare classica, occulta o mista, con dimensione fino a 12 diametri
papillari, e con AV nell’occhio trattato tra i 20/40 e 20/320.14 Circa 1200
pazienti di oltre 50 anni sono stati trattati con dosaggi intravitreali di
pegaptanib di 0.3 mg, 1 mg o 3 mg, oppure con placebo, ogni 6 settimane per 48
settimane per un totale di 9 iniezioni. In alcuni dei pazienti con CNV
prevalentemente classica è stata eseguita anche la PDT secondo la discrezione
del curante, per motivi di etica professionale. Dopo il primo anno di follow up
1050 pazienti sono stati ri-randomizzati alla continuazione del trattamento o
meno.
L’obbiettivo principale era la valutazione del numero di pazienti con perdita
visiva minore di 3 linee a 1 anno (15 lettere).
A 1 anno di distanza è stata dimostrata un’efficacia statisticamente rilevante
per tutte e tre le dosi paragonate al placebo per quanto riguarda la riduzione
dell’AV a meno di 15 lettere (3 linee), la riduzione del rischio di perdita
visiva severa (riduzione di 30 o più lettere) e il numero di pazienti che hanno
avuto un’AV stabile o aumentata.
Il 70% dei pazienti (P<0.001) trattati con 0.3 mg, il 71% (P<0.001) dei trattati
con 1.0 mg e il 65% (P=0.03) del gruppo dei 3.0 mg, persero meno di 15 lettere
all’AV rispetto al 55% del placebo.
Il rischio di una severa perdita visiva è stato ridotto dal 22% del gruppo di
controllo a 10% (P<0.001), 8% (P<0.001) e 14% (P=0.01) del gruppo dei 0.3 mg,
del 1 mg e dei 3 mg, rispettivamente.
Il 33% (P=0.003), il 37% (P<0.001) ed il 31% (P=0.02) dei pazienti dei 3 diversi
gruppi mantennero o guadagnarono in AV, rispetto al 23% dei controlli,
differenza che risultava statisticamente significativa.14
Si osservò una maggiore percentuale di pazienti trattati con PDT nei placebo
rispetto ai gruppi trattati (rispettivamente 25% vs 19%), suggerendo un effetto
benefico della terapia con pegaptanib e quindi una minore necessità di
trattamenti alternativi.
Il pegaptanib è in grado di indurre un rallentamento statisticamente rilevante
rispetto al placebo, nella crescita dell’area totale della lesione, nella
grandezza della CNV e nel grado di leakage di tutte le lesioni, com’è stato
documentato con le angiografie.
Effetti collaterali: Gli effetti collaterali più gravi che sono stati segnalati,
associati a grave perdita visiva, erano: endoftalmite nel 1.3%, cataratta
traumatica iatrogena nel 0,7% e distacco retinico nel 0.6% dei pazienti.
Quelli più frequentemente riscontrati (10-40% dei pazienti) con dosi di farmaco
di 0.3 - 3 mg erano: infiammazione della camera anteriore, visione offuscata o
ridotta, cataratta, emorragia congiuntivale, edema corneale, cheratite puntata,
secrezione, irritazione o dolore oculare, ipertensione, ipertono e opacità
vitreali fluttuanti.
Nel 6-10% dei pazienti sono stati riscontrati casi di blefarite, congiuntivite,
fotopsia, bronchite, diarrea, cefalea, nausea e infezioni del tratto urinario.
Più raramente, nel 1-5% dei pazienti sono stati segnalati altri effetti
collaterali, di solito modesti. Non sono note manifestazioni anomale a lungo
termine.
Nei pazienti con insufficienza renale, specialmente se severa, sono stati
riscontrati valori di emivita plasmatica altamente variabili per le iniezioni
intravitreali di 3 mg. Non ci sono dati per quanto riguarda i pazienti
sottoposti ad emodialisi o con epatopatie.
Tossicità ed immunogenicità: Fino ad ora non ci sono studi sulle donne in
gravidanza, in allattamento o sui bambini; pertanto si consiglia particolare
attenzione e valutazione del rapporto rischio/beneficio.
Conservazione: Il farmaco si conserva in una temperatura tra i 2°C e gli 8°C. Si
inietta a temperatura ambiente, pertanto si consiglia di toglierlo dal frigo 30
minuti - 4 ore prima dell'uso.
Modo di somministrazione: Il MACUGEN® si deve iniettare rispettando tutti gli
accorgimenti di asepsi e sicurezza pre-, intra- e postoperatori che si usano per
ogni iniezione intravitreale. La frequenza di somministrazione è stata stabilita
essere di una volta ogni 6 settimane.
Pratica: Il farmaco è oggi disponibile anche in Italia ad un prezzo di circa 800
euro ed ha una indicazione per la degenerazione maculare senile.
Conclusioni: I risultati ad un anno degli studi clinici multicentrici,
randomizzati, a doppio cieco, sono promettenti. Tuttavia rimangono da accertare
gli effetti a lungo termine e la compliance del paziente, essendo questa una
terapia da somministrarsi ogni 6 settimane.
La scoperta di una nuova terapia offre anche la possibilità di usufruire del
maggior effetto positivo di trattamenti combinati.
La combinazione della terapia fotodinamica con l’iniezione intravitreale di
pegaptanib sodico ed eventualmente con gli steroidi intravitreali, oltre a
sommare gli effetti benefici di azioni diverse (riduzione di un eventuale
distacco dell’EPR, chiusura dei neovasi, e contrasto dell’aumento secondario di
VEGF), potrà sicuramente permettere risultati migliori e più duraturi, con la
conseguente riduzione della frequenza di somministrazione.
Bibliografia
Soubrane G, Haddad WM, Coscas G. Age-related macular degeneration Presse Med.
2002 Aug 24;31(27):1282-7.
Ciulla TA, Danis RP, Criswell M, Pratt LM. Changing therapeutic paradigms for
exudative age-related macular degeneration: antiangiogenic agents and
photodynamic therapy. Expert Opin Investig Drugs. 1999 Dec;8(12):2173-2182.
Schnurrbusch UE, Welt K, Horn LC, Wiedemann P, Wolf S. Histological findings of
surgically excised choroidal neovascular membranes after photodynamic therapy.
Br J Ophthalmol. 2001 Sep;85(9):1086-91.
Schmidt-Erfurth U, Schlotzer-Schrehard U, Cursiefen C, Michels S, Beckendorf A,
Naumann GO. Influence of photodynamic therapy on expression of vascular
endothelial growth factor (VEGF), VEGF receptor 3, and pigment
epithelium-derived factor. Invest Ophthalmol Vis Sci. 2003 Oct;44(10):4473-80.
Rudolf M, Michels S, Schlotzer-Schrehardt U, Schmidt-Erfurth U. Expression of
angiogenic factors by photodynamic therapy. Klin Monatsbl Augenheilkd. 2004 Dec;221(12):1026-32.
Aparicio S, Sawant S, Lara N, Barnstable CJ, Tombran-Tink J. Expression of
angiogenesis factors in human umbilical vein endothelial cells and their
regulation by PEDF. Biochem Biophys Res Commun. 2005 Jan 14;326(2):387-94.
Postelmans L, Pasteels B, Coquelet P, El Ouardighi H, Verougstraete C,
Schmidt-Erfurth U. Severe pigment epithelial alterations in the treatment area
following photodynamic therapy for classic choroidal neovascularization in young
females. Am J Ophthalmol. 2004 Nov;138(5):803-8.
Wachtlin J, Behme T, Heimann H, Kellner U, Foerster MH. Concentric retinal
pigment epithelium atrophy after a single photodynamic therapy. Graefes Arch
Clin Exp Ophthalmol. 2003 Jun;241(6):518-21. Epub 2003 May 7.
Schlingemann RO. Role of growth factors and the wound healing response in
age-related macular degeneration. Graefes Arch Clin Exp Ophthalmol. 2004 Jan;242(1):91-101.
Epub 2003 Dec 18.
Adamis AP, Miller JW, Bernal M-T, et al. Increased vascular endothelial growth
factor levels in the vitreous of eyes with proliferative diabetic retinopathy.
Am J Ophthalmol 1994;118:445-50.
Aiello LP, Avery RL, Arrigg PG, et al. Vascular endothelial growth factor in
ocular fluid of patients with diabetic retinopathy and other retinal disorders.
N Engl J Med 1994; 331:1480-7.
Lichtenbeld HHC, Van Dam-Mieras MCE, Hillen HFP. Humour angiogenesis:
pathophysiolgy and clinical significance. Netherlands Journal of Medicine 49
(1996) 42-51
Liekens S, De Clercq E, Neyts J. Angiogenesis: regulators and clinical
applications. Biochemical Pharmacology 61 (2001) 253-270.
Gragoudas ES, et al. Pegaptanib for Neovascular Age-Related Macular Degeneration.
N Engl J Med 2004; 351; 27: 2805-16.
LUCENTIS (Ranibizumab)
Il ranibizumab (RhuFab V2; Lucentis, Genentech, Novartis) è un frammento
anticorpale umanizzato derivato dal bevacizumab che lega e blocca tutte le forme
di VEGF (VEGF165, VEGF121, and VEGF110) nello spazio extracellulare.
Rispetto al bevacizumab, Lucentis è una molecola più piccola che ha delle
proprietà peculiari quali il piccolo raggio e il minor peso molecolare (48 kD)
che giustificano la maggior capacità di penetrare tutti gli strati della retina
e quindi di diffondere nello spazio sottoretinico dopo somministrazione
intravitreale.
Il meccanismo di azione consiste nell’inibizione della crescita neovascolare e
nella riduzione della permeabilità vascolare.
Il farmaco viene iniettato per via intravitreale per massimizzare l’effetto
inibitorio del VEGF nella retina mentre si minimizza l’inibizione sistemica del
VEGF e non si interferisce con il suo ruolo fisiologico nei tessuti dei
territori extraoculari.
Emivita nel corpo vitreo e nel plasma
Studi di farmacocinetica su animali di laboratorio hanno dimostrato che dopo
iniezione intravitreale la biodisponibilità del ranibizumab e’ molto elevata (50
– 60%) in quanto il farmaco si distribuisce rapidamente nella retina nell’arco
di 6 – 24 ore e viene eliminato da tutti i compartimenti oculari con 2
principali pathways di uscita: 1) verso la camera anteriore e 2) verso la
retina; l’emivita del farmaco è breve, circa 3 giorni.
Le concentrazioni del ranibizumab nel plasma sono molto basse, riflettendo una
biodistribuzione più alta e una clearance più bassa del farmaco nell’occhio.
Tuttavia non abbiamo dati disponibili sulla clearance del farmaco dal vitreo
umano anche se si può ipotizzare che potrebbe essere più lenta a causa del
maggior volume del vitreo umano (4.5 mL) rispetto al quello degli occhi di
coniglio o di scimmia (1.5 mL).
Allo stato attuale delle conoscenze non sono state riscontrate tracce di
ranibizumab nel plasma dopo iniezione del farmaco in pazienti affetti da AMD
neovascolare.
Studi clinici internazionali
MARINA (Minimally classic/occult trial of the Anti-VEGF antibody
Ranibizumab In the treatment of Neovascular AMD): include 716 pazienti con AMD e
CNV minimamente classica o occulta trattati con 0,3 o 0,5 mg/mese di ranibizumab
intravitreale e paragonati con pazienti trattati con placebo. I risultati ad un
anno, riportavano che il 95% dei pazienti con AMD essudativa trattati con
iniezioni intravitreali di Lucentis, aveva un’acuità visiva migliorata o stabile
(perdita in acuità visiva minore di 15 lettere), rispetto al 62% dei
pazienti del gruppo di controllo trattati con PDT (P<0,0001). Il trattamento era
in grado di aumentare l’acuità visiva media rispetto a quella iniziale: 25-34%
dei pazienti trattati rispetto al 5% del gruppo di controllo (P<0,0001). In
media i pazienti trattati con Lucentis leggevano più di 7 lettere rispetto alla
visita iniziale, mentre i pazienti trattati con il placebo leggevano mediamente
10,5 lettere in meno. Circa il 40% dei pazienti trattati con Lucentis aveva un
acuità visiva nell’occhio trattato migliore o uguale a 20/40, rispetto all’11%
del gruppo di controllo. Gli effetti collaterali più importanti, riscontrati
nell’ <1% dei pazienti erano l’uveite e l’ endoftalmite.
ANCHOR (ANti-VEGF Antibody for the Treatment of Predominantly Classic
CHORoidal Neovascularization in AMD): questo studio include 423 pazienti con AMD
con neovascolarizzazione prevalentemente classica trattati con due dosi diverse
di Lucentis paragonati con pazienti trattati con PDT. Studio di fase III,
randomizzato, multicentrico, a doppio cieco. I risultati ad un anno riportavano
un miglioramento o stabilità dell’acuità visiva (perdita minore di 15 lettere)
nel 95% dei pazienti trattati con Lucentis rispetto al 64% di quelli trattati
con PDT (P<0,0001). L’acuità visiva migliorava per più di 15 lettere nel 36%-40%
degli occhi trattati con ranibizumab e solo nel 5,6% degli occhi trattati con
PDT. (P<0,0001). I pazienti trattati con Lucentis ad un anno di distanza,
leggevano mediamente, 8,5-11,3 lettere in più rispetto alla partenza, mentre
quelli trattati con la PDT, 9,5 lettere in meno. Le differenze in acuità visiva
tra i due gruppi, erano confermate (rafforzate) dalle differenze in leakage e in
spessore maculare riscontrate all’angiografia e all’OCT rispettivamente. Nei
pazienti trattati con ranibizumab intravitreale sono stati riscontrati 2 casi di
endoftalmite (0,7%), uno di uveite (0,4%), un distacco di retina(0,4%), e una
emorragia intravitreale(0,4%). Nel 25% dei pazienti è stato osservato un qualche
grado di infiammazione intraoculare.
PIER (Phase IIIb, Multicenter, Randomized, Double-Masked, Sham
Injection-Controlled Study of the Efficacy and Safety of Ranibizumab in Subjects
with Subfoveal Choroidal Neovasularization with or without Classic CNV Secondary
to Age-Related Macular Degeneration) è uno studio condotto su 184 pazienti (CNV
classica, minimamente classica, o occulta) randomizzati a ricevere 0.3 mg o 0.5
mg di ranibizumab intravitreale o una sham injection ogni mese per i primi 3
mesi e successivamente ogni 3 mese per 2 anni. I primi risultati disponibili
(press release giugno 2006) indicano che sono stati raggiunti degli end-points
significativi. A 3 mesi si è avuto un miglioramento di 2.9 lettere ETDRS
(gruppo: dose 0.3 mg) e di 4.3 lettere (gruppo: dose 0.5 mg) rispetto alla
perdita di 8.7 lettere tra i pazienti del gruppo di controllo. Dopo i primi 3
mesi, i pazienti ricevettero iniezioni supplementari a 5, 8 e 11 mesi. Dopo 12
mesi i pazienti trattati con Lucentis erano stabili, mentre i pazienti del
gruppo di controllo hanno sperimentato una perdita significativa dell’AV. A 1
anno i gruppo di paz. trattati con Lucentis hanno perso 1.6 lettere (gruppo:
dose 0.3 mg) e 0.2 lettere (gruppo: dose 0.5 mg) rispetto alla perdita di 16.3
lettere nel gruppo di controllo ( P 0.0001).
FOCUS (RhuFab V2 Ocular Treatment Combining the Use of Visudyne to
Evaluate Safety) è uno studio condotto su 162 pazienti con CNV classica per
valutare gli effetti della PDT con verteporfina associata all’iniezione
intravitreale di 0,5 mg di Lucentis. I risultati estrapolati a 1 anno hanno
dimostrato che il 90.5% dei pazienti nel gruppo trattato con PDT + Lucentis
aveva perso meno di 15 lettere (3 linee) di AV rispetto al 68% dei pazienti nel
gruppo di controllo sottoposto solo a PDT (p = 0.003). Inoltre il 23.8% dei
pazienti trattati con PDT + Lucentis avevano un guadagno 15 lettere rispetto al
5.4% del gruppo trattato con la sola PDT.
SAILOR (Safety Assessment of Intravitreal Lucentis fOR AMD): è uno studio
ongoing che coinvolge 101 centri negli Stati Uniti per arruolare una popolazione
di 5.000 pazienti affetti da AMD, con tutti i sottotipi di neovasi subfoveali,
di prima diagnosi o ricorrenti attivi, per valutare la sicurezza del Lucentis
somministrato per via intravitreale (0.3 mg e 0.5 mg) con 1 iniezione al mese
per i primi 3 mesi e valutando poi la necessità del ritrattamento in base alla
risposta clinico-angiografica.
Il farmaco è commercializzato in Italia dalla Novartis, è stato approvato in
Svizzera e può essere importato dall’estero. Il prezzo è di circa 1600 euro ed
ha una indicazione per la degenerazione maculare senile.
Bibliografia
Michels S, Rosenfeld PJ.Treatment of neovascular age-related macular
degeneration with Ranibizumab/Lucentis Klin Monatsbl Augenheilkd. 2005 Jun;222(6):480-4.
Rosenfeld PJ, Schwartz SD, Blumenkranz MS, Miller JW, Haller JA, Reimann JD,
Greene WL, Shams N. Maximum tolerated dose of a humanized anti-vascular
endothelial growth factor antibody fragment for treating neovascular age-related
macular degeneration. Ophthalmology. 2005 Jun;112(6):1048-53.
Rosenfeld PJ, Heier JS, Hantsbarger G, Shams N. Tolerability and efficacy of
multiple escalating doses of ranibizumab (Lucentis) for neovascular age-related
macular degeneration. Ophthalmology. 2006 Apr;113(4):632.e1.
Heier JS, Antoszyk AN, Pavan PR, Leff SR, Rosenfeld PJ, Ciulla TA, Dreyer RF,
Gentile RC, Sy JP, Hantsbarger G, Shams N. Ranibizumab for treatment of
neovascular age-related macular degeneration: a phase I/II multicenter,
controlled, multidose study. Ophthalmology. 2006 Apr;113(4):642.e1-4. Epub 2006
Feb 14.
Husain D, Kim I, Gauthier D, Lane AM, Tsilimbaris MK, Ezra E, Connolly EJ,
Michaud N, Gragoudas ES, O'Neill CA, Beyer JC, Miller JW. Safety and efficacy of
intravitreal injection of ranibizumab in combination with verteporfin PDT on
experimental choroidal neovascularization in the monkey. Arch Ophthalmol. 2005
Apr;123(4):509-16.
Eylea (Aflibercept)
E'
l’unica proteina di fusione completamente umana, potente
inibitore dell’Angiogenesi, che lega tutte le isoforme
del VEGF-A ,VEGF-B nonché il Fattore di Crescita
Placentare (PlGF) trovato in quantità eccessiva nella
retina delle persone affette da Degenerazione Maculare
Senile.
EYLEA ha un’affinità di legame più alta del recettore
naturale del VEGF e degli altri anticorpi anti-VEGF.
Grazie al suo specifico meccanismo d’azione, EYLEA
intrappola e blocca il VEGF, proprio come le chele di
un’aragosta che cattura la sua preda.
La Terapia con Bevacizumab (Avastin®) a livello INTRAOCULARE.
Informazioni di carattere generale: La degenerazione maculare legata all’età è
una malattia della retina che colpisce preferenzialmente i soggetti anziani nei
quali danneggia progressivamente e in modo irreversibile la macula che è
deputata alla visione distinta dei dettagli visivi per lontano e per vicino,
alla visione cromatica, e alla sensibilità al contrasto. La degenerazione
maculare rappresenta una delle malattie oculari più invalidanti nei paesi
industrializzati dopo i 55 anni, colpendo circa l’8% della popolazione, e
raggiungendo il 30% dopo i 75 anni. Tale malattia è pertanto molto diffusa nella
popolazione anziana ed è destinata ad aumentare con l’allungamento dell’età
media e delle aspettative di vita.
La degenerazione maculare viene generalmente classificata in una forma secca o
atrofica a carattere cronico, lento e progressivo ed in una forma essudativa o
umida, più rapida ed aggressiva, altamente invalidante e caratterizzata, in modo
distintivo, dalla presenza di una neovascolarizzazione coroideale (CNV).
La diagnosi della malattia viene effettuata prevalentemente con la
fluorangiografia associata o meno all’angiografia con verde indocianina, esami
che permettono il più delle volte di individuare la neovascolarizzazione
sottoretinica, stabilirne la sede, le dimensioni e valutarne il tipo.
I criteri di classificazione angiografica della degenerazione maculare legata
all’età si basano sull’aspetto della CNV che viene distinta in:
classica, cioè ben definita alla fluorangiografia, dividendola in
prevalentemente classica (superiore a 50% delle lesione), minimamente classica
(uguale o inferiore a 50%,
occulta quando la CNV non è visibile alla fluorangiografia.
Esistono poi dei sottogruppi come la RAP (Retinal Angiomatous Proliferation) o
la vasculopatia polipoidale. L’importanza di tale suddivisione dipende da fatto
che i vari tipi di CNV hanno prognosi e follow-up diversi.
La CNV è poi presente in numerose altre affezioni oculari come la degenerazione
maculare miopica, nelle strie angioidi, in alcune forme giovanili.
La terapia della degenerazione maculare neovascolare consiste nella
fotocoagulazione laser anche se la sua principale limitazione è dovuta sia alla
parziale efficacia che alla ridotta percentuale di pazienti cui è applicabile,
circa il 20%. Infatti la terapia laser non può essere effettuata nelle CNV
subfoveali centrali. In tali casi, che sono la maggioranza, può essere
effettuata la terapia fotodinamica (PDT), che, iniziata nel gennaio 2000,
rappresenta oggi lo “standard care” nella terapia delle CNV localizzate sotto il
centro geometrico della fovea. Lo scopo principale della terapia è quello di
stabilizzare la lesione neovascolare cercando di impedirne l’allargamento e
quindi la perdita visiva.
La PDT non è però ugualmente efficace in tutti i casi e i tipi di CNV, per cui
c’è la necessità di avere qualche altra alternativa terapeutica, come la
possibilità di effettuare trattamenti combinati che possano potenziarne
l’efficacia.
L’angiogenesi e la terapia antiangiogenetica: Lo straordinario patrimonio di
conoscenze scientifiche acquisite nell’ultimo decennio nel campo dell’angiogenesi
e della terapia anti-angiogenica ci sta aiutando a trovare nuove soluzioni non
solo nella cura dei tumori ma anche nella terapia di alcune malattie oculari ad
impronta vasogenica, emorragica ed essudativa come la degenerazione maculare
legata all’età, dove è necessario intervenire con trattamenti altamente
selettivi per evitare la distruzione delle cellule neurosensoriali della retina
centrale.
Alcuni trials clinici hanno dimostrato il beneficio clinico della terapia
farmacologica anti-angiogenica che, attraverso l’inibizione del VEGF umano
(acronimo di Vascular Endothelial Growth Factor) ovvero del fattore di crescita
delle cellule endoteliali, blocca la genesi vascolare della malattia.
Attualmente, si stanno sperimentando alcuni farmaci che, iniettati dentro
l’occhio, tendono a far regredire i neovasi e ad arrestare la perdita delle
funzioni visive centrali.
Attualmente è disponibile una nuova cura farmacologica sperimentale che utilizza
il bevacizumab (AVASTIN®) ovvero un anticorpo monoclonale umanizzato anti-VEGF,
prodotto mediante la tecnica del DNA ricombinante, che ha dimostrato di
possedere spiccate attività antiangiogeniche/antiedemigene e di arrestare la
genesi vascolare della malattia.
In una serie di casi trattati con bevacizumab,2-5 alcuni ricercatori hanno
evidenziato come questo farmaco abbia un effetto inibitorio sullo sviluppo della
rete neovascolare che si esplica mediante il blocco del pathway molecolare che
porta il VEGF ad agire sul trofismo endoteliale e sull’input pro-angiogenico.
La terapia prevede l’iniezione intraoculare della sostanza che, diffondendo nel
corpo vitreo e nello spessore della retina, giunge a contatto con la CNV dove
esercita essenzialmente una serie di effetti caratterizzati da:
Inibizione della crescita e dell’estensione del processo neovascolare.
Regressione della neovascolarizzazione.
Stabilizzazione delle membrane endoteliali e decremento del grado di
permeabilità nel microcircolo della CNV.
Riduzione dell’intensità di diffusione delle molecole proteiche e lipidiche
negli spazi extravascolari, diminuzione dell’edema e normalizzazione dello
spessore retinico maculare centrale.
La realizzazione di questi effetti può produrre risultati di rilevanza clinica
in quanto il farmaco ha la potenzialità di controllare la gravità della malattia
e di rallentarne la progressione nel tempo.
Un’ altro effetto dell’inibizione del VEGF mediante bevacizumab è la possibilità
di creare un terreno microvascolare più simile a quello normale in cui la
ridotta permeabilità dei neovasi, la diminuzione dell’edema retinico, e la
migliore ossigenazione della neovascolarizzazione avrebbe la potenzialità di
incrementare la biodisponibilità di O2 dentro la CNV e di aumentare la
sensibilità alla PDT.
L’AVASTIN® (bevacizumab): Avastin® è un nuovo farmaco che viene utilizzato in
terapia oncologica per bloccare la crescita della rete neovascolare anarchica
nell’ambito di forme tumorali metastatiche del colon-retto.
Meccanismo di azione: Avastin® è un anticorpo monoclonale umanizzato che esplica
la sua attività mediante l’inibizione del Vascular Endothelial Growth Factor (VEGF)
- una proteina naturale che regola il processo dell’angiogenesi, nelle sue
diverse tappe, dallo sviluppo alla maturazione dei vasi neoformati.
La secrezione del VEGF è intensa nei tessuti ischemici e in quelli ad elevata
attività proliferativa dove ad un’elevata domanda di saturazione di ossigeno la
risposta biologica porta alla neoformazione di vasi anomali, alla
vasodilatazione compensatoria e all’aumento della permeabilità vascolare per
intensificare la portata ematica e l’ossigenazione cellulare loco-regionale.
Le possibili applicazioni dell’avastin al di fuori del campo oncologico
riguardano la terapia delle degenerazioni maculari di tipo neovascolare, e delle
malattie vascolari della retina caratterizzate da una marcata componente
edematosa ed essudativa come la retinopatia diabetica e l’occlusione della vena
centrale della retina.
La Safety: I dati relativi al profilo di sicurezza clinica del bevacizumab
possono essere estrapolati dalle sperimentazioni in fase II e III che hanno
valutato gli effetti del farmaco nel trattamento di prima linea dei tumori
primari e metastatici.
Gli effetti collaterali avversi più comuni correlati alla via di
somministrazione sistemica sono:
Ipertensione arteriosa sistemica dose-dipendente: L’ipertensione arteriosa ha
un’incidenza che varia dal 22.4 al 32% ed è reversibile nell’84% dei casi
mediante terapia anti-ipertensiva. Essa è correlata al blocco del VEGF umano che
determina una ridotta produzione di ossido nitrico (NO) e una ridotta escrezione
renale di sodio con aumento del volume plasmatico circolante.
Proteinuria asintomatica: L’incidenza della proteinuria asintomatica è stata
osservata nel 21.7 - 38% dei pazienti. La sua comparsa non è associata a
disfunzione renale e non preclude la continuazione del trattamento. La sindrome
nefrosica è rara ed impone la sospensione della terapia.
Tromboembolia arteriosa: L’incidenza degli eventi tromboembolici (ictus
cerebrale, TIA, infarto del miocardio) è risultata simile nei gruppi trattati
con Avastin (range 18.0 – 19.4%) e nei gruppi placebo ( 16.2 – 18.3%). Il
rischio è maggiore per pazienti con età superiore ai 65 anni o con una storia di
tromboembolismo arterioso.
Ritardo sulla cicatrizzazione delle ferite: Un rallentamento nel tempo di
cicatrizzazione delle ferite si è riscontrato nei pazienti che erano stati
sottoposti a intervento chirurgico durante il trattamento anti-angiogenico.
Eventi emorragici : La tendenza all’emorragia cutanea (petecchie, ecchimosi) o
mucosa (epistassi) dipende dal blocco della capacità proliferativa
dell’endotelio. L’incidenza è del 3.1 –5.1%.
Perforazioni gastrointestinali: Questa complicanza è rara (1,4 – 2,0%) ma
potenzialmente fatale (0.4 – 1.0%).
Rischi quando l’Avastin è utilizzato per trattare malattie oculari. Gli oculisti
ritengono che il rischio di queste complicanze per i pazienti con patologie
oculari sia basso. Infatti i pazienti che ricevono l’Avastin per malattie
oculari sono in generale in uno stato di salute migliore rispetto ai pazienti
con tumori del colon-retto metastatico e ricevono una dose significativamente
inferiore che è rilasciata solo all’interno dell’occhio. Mentre non esistono
sperimentazioni approvate dalla FDA americana nè dal Ministero della Salute che
dimostrino la sicurezza e l’efficacia dell’Avastin all’interno dell’occhio,
esistono negli Stati Uniti sperimentazioni cliniche di farmaci simili così come
studi di pazienti che stanno ricevendo l’Avastin “fuori indicazione”. In
particolare uno studio di pazienti che hanno ricevuto l’Avastin endovena ha
riportato solo una lieve elevazione della pressione arteriosa. Un altro studio
di pazienti trattati con le medesime modalità che le vengono proposte e cioè
mediante una iniezione intraoculare di Avastin non ha portato a elevazioni della
pressione arteriosa o ad altri problemi osservati invece in pazienti con il
cancro.
Tuttavia è importante anche sottolineare che i benefici e i rischi dell’ Avastin
iniettato dentro l’occhio non sono completamente conosciuti.
Procedura per l’iniezione intravitreale di bevacizumab. La procedura viene
eseguita in Ospedale in regime di day surgery.Il consenso informato è letto e
discusso con il paziente.
L’iniezione intravitreale viene quindi eseguita in condizioni di sterilità, in
sala operatoria, previa anestesia topica con colliri. Dopo l’iniezione il
paziente viene tenuto in osservazione per qualche ora e controllato nei giorni
successivi.
L’Avastin essendo una terapia off-label non può più essere utilizzata nelle
neovascolarizzazioni mentre mantiene un suo ruolo negli edemi maculari. Inoltre
la nuova finanziara ne prevede un uso molto limitato, e solo nell’ambito di
protocolli clinici.
Bibliografia
Photodynamic therapy study group. Photodynamic therapy of subfoveal choroidal
neovascularization in age-related macular degeneration with verteporfin:
one-year results of 2 randomized clinical trials--TAP report. Treatment of
age-related macular degeneration with photodynamic therapy (TAP) Study Group.
Arch Ophthalmol. 1999 Oct;117(10):1329-45.
Nguyen QD, Shah S, Tatlipinar S, Do DV, Anden EV, Campochiaro PA. Bevacizumab
suppresses choroidal neovascularisation caused by pathological myopia.
Br J Ophthalmol. 2005 Oct;89(10):1368-70.
Rosenfeld PJ, Moshfeghi AA, Puliafito CA.Optical coherence tomography findings
after an intravitreal injection of bevacizumab (avastin) for neovascular
age-related macular degeneration. Ophthalmic Surg Lasers Imaging. 2005 Jul-Aug;36(4):331-5.
Reichel E.Intravitreal bevacizumab for choroidal neovascularization and cystoid
macular edema: cost-effective treatment?
Ophthalmic Surg Lasers Imaging. 2005 Jul-Aug;36(4):270-1.
Michels S, Rosenfeld PJ, Puliafito CA, Marcus EN, Venkatraman AS. Systemic
bevacizumab (Avastin) therapy for neovascular age-related macular degeneration
twelve-week results of an uncontrolled open-label clinical study. Ophthalmology.2005Jun;112(6):1035-47.
Quale farmaco usare nelle degenerazioni maculari?
Come abbiamo visto è oggi possibile utilizzare diverse terapie per la
degenerazione maculare caratterizzata dalla presenza di neovasi sottoretinici.
Dipende dal tipo di lesione vascolare, dalla sede e perché no anche da aspetti
di tipo socio economico.
Il laser tradizionale, inteso come sorgente di calore in grado di distruggere
completamente la lesione è oggi poco utilizzato e solamente nei casi in cui la
lesione è distante dal centro, in quanto lascia una cicatrice molto ampia che si
traduce con una macchia molto fastidiosa per la persona. Quando la lesione è
centrale la terapia di scelta ad oggi è la fotodinamica. Sino a poco a tempo fa
era necessario effettuarne circa 4 il primo anno e 2 il secondo anno per
ottenere in circa il 50% dei casi una stabilità, non un miglioramento della
vista.
Oggi è tendenza non solo mia personale, che, se dopo 2-3 fotodinamiche vediamo
che il risultato non è molto brillante o molto limitato nel tempo, interveniamo
con una iniezione intravitreale di alcune sostanze per bloccare la crescita
della lesione. I farmaci oggi che iniettiamo sono praticamente tre in quanto il
triamcinolone per gli effetti collaterali negativi è stato praticamente
abolito,l’Avastin, il Macugen ed il Lucentis. L’azione dei singoli farmaci che è
stata descritta in precedenza ha durata limitata ed è necessario effettuare le
iniezione dalle 6 alle 8 volte l’anno, anche se per il Lucentis. È descritto
addirittura un miglioramento visivo sino al 40%.
Ci sono poi delle normative di legge che ci dicono che: l’Avastin non può essere
più usato per le lesioni neovascolari in quanto ci sono per l’appunto sia
Macugen che Lucentis che hanno una indicazione specifica per l’uso oculistico.
Entrambi questi due farmaci sono oggi disponibili, anche se il Macugen può
essere comprato solo da ospedali o case di cura, e il Lucentis deve essere
importato dall’estero. Nel nostro centro Lei potrà trovare tutte le informazioni
riguardanti le modalità di esecuzione della terapia e i costi relativi.
Quale farmaco usare nell’edema maculare?
L’edema cioè la presenza di liquido nella zona centrale è frequente nel
diabetico, nelle trombosi o in altre malattie.
In tal caso si può utilizzare ancora l’Avastin, però normativa di legge impone
che si possa utilizzare in ambiente pubblico “solo nell’ambito di
sperimentazioni cliniche”, per cui in modo molto ridotto, oppure privatamente.
Gli altri farmaci possono essere utilizzati anche se attualmente le indicazioni
delle aziende ne prevedono l’utilizzo nelle neovascolarizzazioni sottoretiniche.
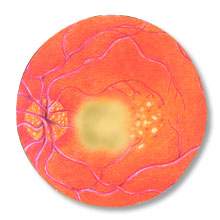 La degenerazione maculare
senile
La degenerazione maculare
senile


